"Compuestos Químicos Inorgánicos."
Iones Monoatómicos y Poliatómicos.
Un ión monoatómico es una especie química, ya sea un átomo o molécula cargada eléctricamente, debido a que ha ganado o perdido electrones como consecuencia de una reacción química.
Los iones con carga negativa producidos por la ganancia de electrones reciben el nombre de aniones, y los que poseen carga positiva debido a la pérdida de electrones reciben el nombre de cationes.
Un ión monoatómico contiene solamente un átomo.
Un ión poliatómico contiene más de un átomo.
Construcción de Fórmulas de los Compuestos Químicos.

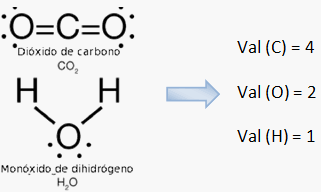
Valencia: capacidad que tienen los elementos para ganar o perder electrones, en algunos coincide con el grupo al que pertenecen; no tienen signo.
Estado de oxidación: tiene signo porque se considera a las uniones como iónicas por lo tanto es positivo si el átomo pierde electrones o los comparte con un átomo más electronegativo. Es negativo si el átomo gana electrones. Los metales por lo tanto tienen números de oxidación positivos porque tienden a ceder electrones. Los no metales tienen número de oxidación negativos.
En general debemos recordar que:
- Los elementos en su estado natural tienen un número de oxidación de cero.
- Los metales en su forma iónica tienen un número de oxidación positiva.
- Los iones de metales alcalinos tienen un número de oxidación de +1
- Los iones de los metales alcalinotérreos tienen un número de oxidación de +2
- En un compuesto la suma algebraica de los números de oxidación debe ser de cero
- El oxígeno trabaja con -2
Todos los compuestos son electricamente neutros a pesar de estar constituidos por unidades que son de naturaleza eléctrica. La valencia y el número de oxidación son dos conceptos importantes a considerar en la escritura de una fórmula química. Para formar fórmulas químicas lo primero será escribir al catión y posteriormente al anión.
CATIÓN + ANIÓN
A+ B-
Para escribir una fórmula química debemos seguir estos pasos:
- Si la valencia o el estado de oxidación de catión y anión es el mismo, se ignoran estos números y se escribe la fórmula.
A+2 B-2
AB
Así queda escrita la fórmula.
- Si el estado de oxidación de catión y anión son múltiplos, se intercambian las valencias (las del catión se convierten en subíndice del anión y la del anión en el subíndice del catión), se escriben como subíndices y se queda sólo el múltiplo.
A+2 B-4
A4B2 = A2B
Así queda la fórmula química escrita.
- Si los estados de oxidación no son múltiplos, se intercambian las valencias y así permanece la fórmula.
A+2 B-3
A3B2
Así queda la fórmula escrita.
- Para nombrar primero se pone el Anión seguido del Catión.
CaO
Óxido de Calcio.
- Se escriben números romanos en los cationes cuando éste tiene varias valencias; el número romano indica la valencia que se está usando en la fórmula.
Cu(NO3)2
Nitrato de Cobre (II)
- Los compuestos químicos inorgánicos por la cantidad de elementos que los forman pueden ser binarios (NaCl), terniarios (HClO) o polinarios (KH2PO4).
ÓXIDO METÁLICO
Metal+O
Los óxidos metálicos, también conocidos como óxidos básicos, están formados por un metal + oxígeno. El oxígeno trabaja con su Valencia 2-.
Nomenclatura:
Stock
Se coloca la palabra "óxido" y después el nombre del no metal, se debe poder el número de oxidación en romano.
Ejemplo:
Ni2O3: óxido de níquel (III)
Si el metal tiene solo un número de oxidación, no se pone el numero en romano al final.
Ejemplo:
HgO: óxido de mercurio

ÓXIDO NO METÁLICO
No Metal +O
Es la unión de un no metal + oxígeno, en la que éste último trabaja con su numero de oxidación 2- . Se encuentra principalmente en los gases de efecto invernadero.
Nomenclatura:
Estequiométrica
Consiste en anteponer a la palabra “óxido” un prefijo que nos indique el número de oxígenos seguida de “de” y el nombre del no metal con un prefijo que nos indique el número de átomos de ese no metal.
ANHÍDRIDOS
No Metal +O
Son compuestos formados por un no metal y oxígeno, también se les llamas óxidos no metálicos u óxidos ácidos.
Nomenclatura:
Tradicional
En está nomenclatura se antepone la palabra "anhídrido" y dependiendo del grupo y número de oxidación se le colocan ciertos sufijos y sufijos a éste.
HIDRÓXIDOS
Óxido básico + H2 O
Metal + OH–
Los hidróxido a son compuestos que resultan de la unión de un óxido básico más agua, o un metal más el ión oxidrilo.
Nomenclatura:
Se nombran igual que un óxido básico, solo cambias la palabra "óxido" por "hidróxido".

HIDRÁCIDOS
H + No Metal
También se les conoce como ávidos hidrácidos.Son combinaciones binarias entre hidrógeno y los halógenos (menos el At) y con los anfígenos (menos el O).
Nomenclatura:
Tradicional
Se coloca la palabra "ácido" seguida del nombre del no metal más el sufijo "hídrico".
Ejemplos:
H2S: ácido sulfhídrico
HBr: ácido bromhídrico

ÁCIDOS OXIGENADOS
Óxido no metálico + H2 O
El ácido oxigenado, también conocido como oxiácido, está formado por un óxido no metálico u óxido básico más agua.
Nomenclatura:
Se coloca la palabra "ácido" más el nombre del no metal con la terminación "ico"
O también se puede usar el nombre específico.
SALES BINARIAS
Metal + No metal
Resultan de la unión binaria de un metal más un no metal (exceptuando al oxígeno y al hidrógeno).
Nomenclatura:
Stock
Se coloca la raíz del no metal con la terminación "uro" seguido de la palabra "de" y el nombre del metal.

SALES OXIGENADAS
Metal+NoMetal+O2 + H2 O
También llamadas oxisales. Se forman por la reacción de un hidróxido con un hidrácido.
Algunas veces estas sales tienen dos metales en vez de un metal y un no metal.
Ejemplo:
Nomenclatura:
Stock
Se escribe la raíz del no metal más la palabra "de" más el metal con su numero de oxidación en romano (en caso de que el metal tenga más de una Valencia).
HIDRUROS
Metal + H
Es la combinación de un metal más hidrógeno, pero en este caso el hidrógeno trabaja con su Valencia 1-.
Nomenclatura:
Los hidratos se pueden formar con variadas nomenclaturas, en la tabla de abajo se muestran los tipos para que quede más claro.

PEROXIDO
X2(O2)n
(donde X es el elemento metálico, O es oxígeno y n es la valencia del elemento metálico).
Los peróxidos son combinaciones binarias del oxígeno con ciertos metales. Son derivados de óxidos que contienen la agrupación -O-O-, O22- llamado ión peróxido.
Nomenclatura:
Stock
Se pone la palabra "Peróxido" seguido de la palabra "de" y el nombre del metal y en número romano su Valencia (en caso de que tenga más de una).

SALES ÁCIDAS
Tienen como fórmula general MHXO
(donde M es el Metal y X es el No Metal)
Para nombrar se utilizan dos maneras:
- Hidrógeno + anión + de + metal
- Anión + ácido + de + metal
Elaboró: Ximena López Ruiz
Escuela de Nivel Medio Superior de Salvatierra
Química I
Ing. Hilda Lucía Cisneros López


